一、临床病史及实验室检查
患者,女性,39岁,6年前无明显诱因出现双乳疼痛,超声检查双乳低回声结节,双乳增生,未行特殊治疗。
2017年1月发现右乳肿块,约“葡萄”大小,质软,无触痛,边界清。于当地行右侧乳腺肿块切除术。术后病理经多家医院会诊,考虑为:导管上皮不典型增生、导管高级别上皮内瘤变,不排除低级别导管原位癌。
2018年3月,查体发现手术瘢痕近乳头侧触及一质韧肿块,大小约3cm×3cm,右腋窝及锁骨上未查见明显异常。
血清学检查:泌乳素明显升高,>4000ng/ml(参考值:3~27ng/ml),高泌乳素血症。期间间断服用过药物溴隐亭,效果不明显后自行停药。
临床症状:闭经、溢乳、无排卵、不孕。
二、影像学检查
乳腺超声:双侧乳腺增生,右乳多发囊实性结节,左乳多发低回声结节。
钼靶:双乳多发结节样密度增高影,考虑BI-RADS 3类,左乳钙化灶,双侧乳腺增生,部分增生融合。
三、手术及病理所见
1.肿块切除术(2017年1月)
(1)手术所见:右乳可见一灰白灰黄囊性区,面积约3cm×2cm,囊性区内可见积乳,周围组织灰黄略粗糙,质稍韧。
(2)病理所见
1)大体:乳腺组织体积3.5cm×2.5cm×1.5cm,切面灰黄灰红,可见乳白色液体流出,并见多个灰白质软结节,直径0.3~0.5cm,与周围组织分界清。
2)镜下:乳腺组织内可见大小不等的扩张导管,其内含有蛋白分泌物,符合囊性高分泌性增生(病例2图1A)。高倍镜下部分导管上皮增生,细胞排列单层或多层,部分细胞核大深染,具有不典型性(病例2图1B)。部分导管管腔内可见微乳头样结构(病例2图1C),细胞异型明显,部分胞质嗜酸,部分胞质空泡状,呈分泌状态,符合高泌乳性导管内癌改变(病例2图1D)。
3)免疫组化:ER阴性,PR阴性,HER-2阴性,EMA阳性,S-100阴性,CK5/6、CD10和P63导管周肌上皮阳性,Ki67指数15%~20%(病例2图2)。
2.改良根治术(2018年3月)
(1)手术所见:右乳上方可见5cm×4cm的增厚区,切开切面广泛乳管扩张并囊肿形成,囊内可见积乳和血性液体。
(2)病理所见
1)大体:乳腺组织体积6cm×5.5cm×3cm,切开切面见一囊实性肿物,囊性区内容血性液体,实性区灰白灰黄,质韧稍硬,肿物切面积3.3cm×1.8cm,界不清。
2)镜下:乳腺组织大部分区域呈多房囊性,可见大小不等的导管扩张,缺乏间质,部分管腔内可见类似甲状腺胶状分泌物(病例2图3A)。增生的导管上皮呈立方或扁平状,可见鞋钉样细胞,细胞呈高分泌状态(病例2图3B)。部分细胞胞质丰富,呈嗜酸性,部分细胞胞质空泡状,核偏位(病例2图3C)。少数细胞核浆比增大,染色质增粗,呈退变样改变。部分区域导管上皮增生明显,可见微乳头样结构(病例2图3D),异型性明显,呈高-中级别导管内癌(病例2图3E)。浸润癌区域的细胞胞质丰富,细胞核呈空泡状,核仁明显(病例2图3F)。
3)免疫组化:浸润性癌区域肿瘤细胞ER阴性,PR阴性,HER-2阴性,CK5/6、P63和Calponin导管周肌上皮阴性,E-cad阴性,P53约80%肿瘤细胞弱阳性,Ki67指数约50%(病例2图4)。
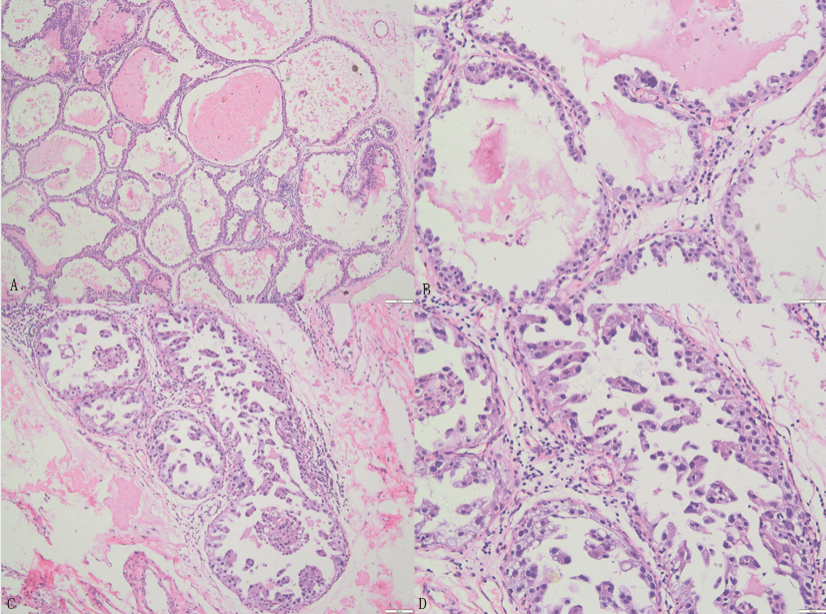
病例2图1 肿块切除(2017年1月)H&E图像
注:A:乳腺组织内可见大小不等的扩张导管,其内含有蛋白分泌物,图像符合囊性高分泌性增生;B:导管扩张、密集,上皮靴钉样增生,部分细胞异型,符合假泌乳性乳腺增生伴不典型增生;C:导管上皮增生,管腔内可见微乳头样结构;D:高倍镜下细胞异型较为明显,部分胞质泡沫样空泡状,呈分泌状态;C和D:均符合高泌乳性导管内癌改变
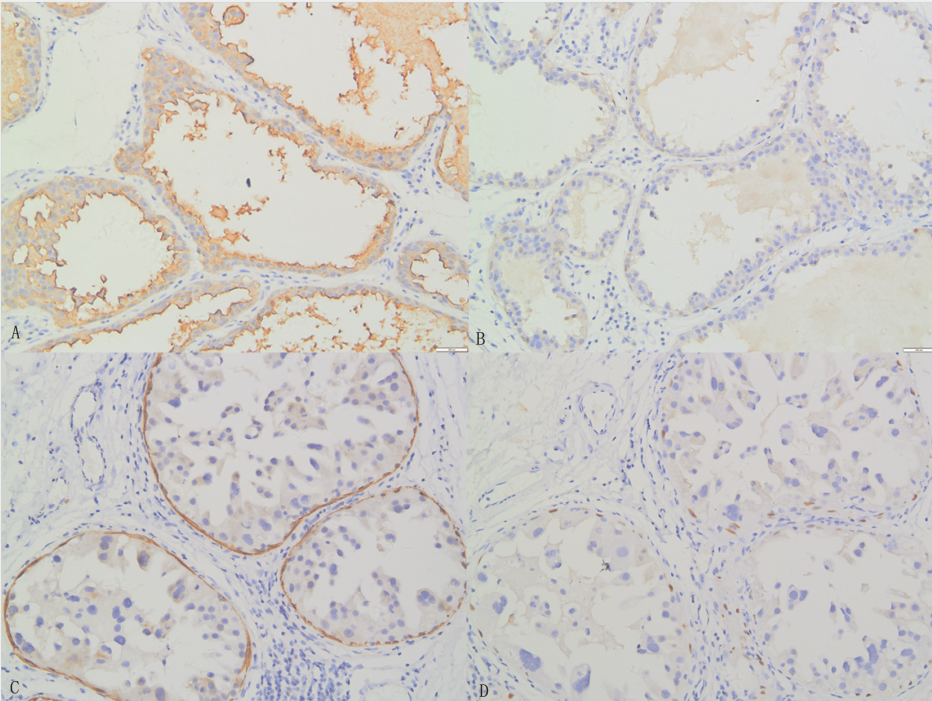
病例2图2 肿块切除免疫组化图像
注:A:肿瘤细胞EMA阳性;B:肿瘤细胞S-100阴性;C:CK5/6导管周肌上皮阳性;D:导管周P63肌上皮阳性
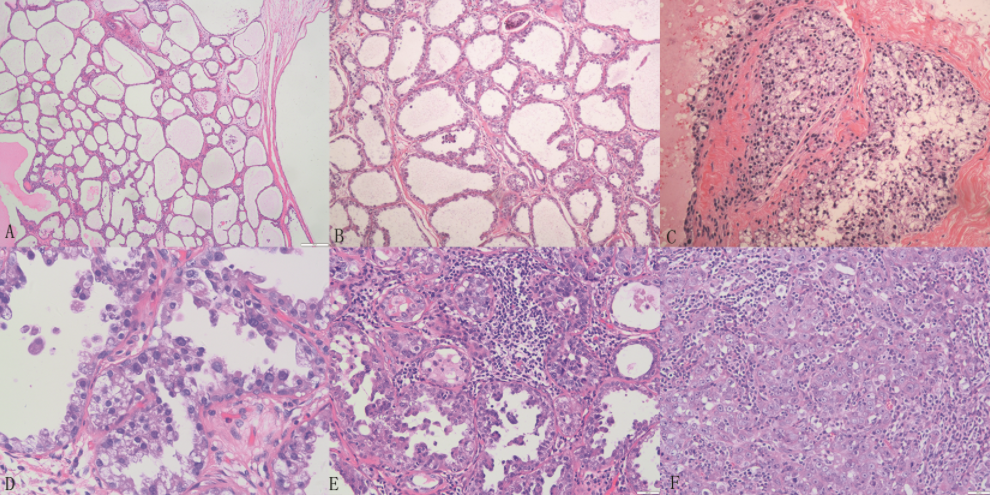
病例2图3 根治术后(2018年3月)H&E图像
注:A:乳腺组织部分区域呈多房囊性,可见大小不等的导管扩张,缺乏间质,部分管腔内可见类似甲状腺胶状分泌物,符合囊性高分泌性增生;B:导管密集,管腔扩大,上皮呈立方或扁平状,可见鞋钉样细胞,符合假泌乳性增生伴不典型增生;C:增生的导管上皮细胞充满管腔,肿瘤细胞胞质呈空泡状;D:部分区域导管上皮部分细胞胞质丰富,呈嗜酸性,部分细胞胞质空泡状,细胞具有异型性;E:大部分区域呈高-中级别导管内癌图像,细胞异型性明显,可见微乳头样结构;C-E:均呈为高泌乳性导管内癌改变;F:浸润癌区域,细胞胞质丰富,细胞核呈空泡状,核仁明显
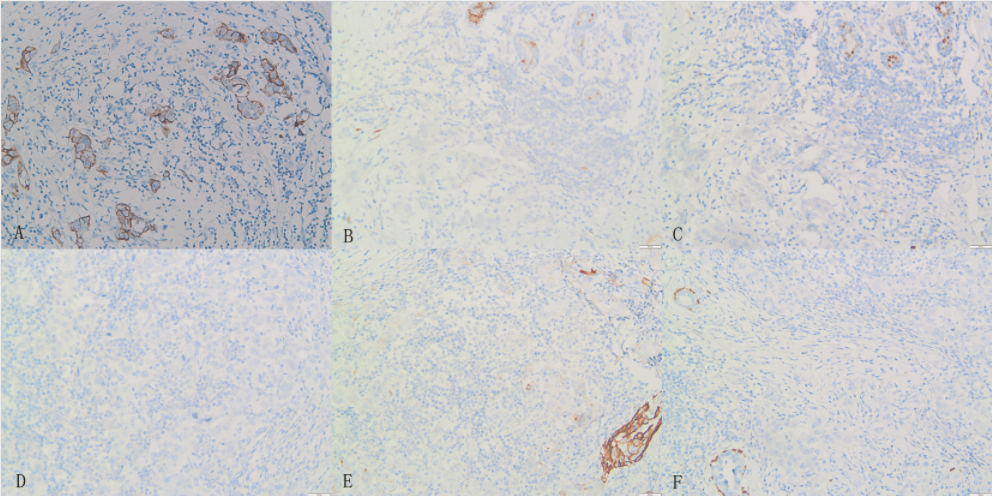
2图4 根治术后免疫组化图像
注:A:免疫组化结果示浸润性癌区域肿瘤细胞CK阳性;B:肿瘤细胞ER阴性;C:肿瘤细胞PR阴性;D:肿瘤细胞HER-2阴性;E:肿瘤细胞CK5/6肌上皮阴性;F:肿瘤细胞P63肌上皮阴性
四、诊断及鉴别诊断
1.诊断 高泌乳素血症乳腺癌(hyperprolactinemia breast cancer)。
2.鉴别诊断
(1)分泌型癌:肿瘤一般边界清楚,病灶中心可有硬化,镜下由不同比例的实性、微囊和管状结构构成,瘤细胞含有丰富的粉染嗜酸性胞质,偶呈泡沫状,核卵圆,有小核仁,核分裂象少见。免疫组化EMA、S-100、α-乳白蛋白常阳性。分子遗传学研究表明该类肿瘤常存在ETV6-NTRK3基因融合。
(2)富于脂质癌:90%肿瘤细胞胞质内含有丰富的中性脂质,瘤细胞大而透明,胞质嗜酸性或空泡状,核圆,核仁明显,缺乏黏液,油红O染色显示细胞胞质内有脂滴存在。
(3)富于糖原透明细胞癌:细胞呈多角形,核圆形、深染,核仁明显,染色质团块状,具有丰富的透明胞质,呈实性生长,其内可见间隔的分枝状毛细血管。透明或颗粒胞质中含有PAS染色阳性的糖原。
五、小结
高泌乳素血症由脑垂体肿瘤、甲状腺功能减退、慢性肾衰竭、药物引发和应激反应等多种原因引起,以血清泌乳素升高及其相关临床表现为主的、下丘脑-垂体轴生殖内分泌紊乱综合征,可累及生殖、内分泌和神经系统。临床表现为泌乳、月经失调与闭经及不孕不育。该患者就诊时未发现垂体和其他脏器的病变,符合特发性高泌乳素血症。
检索数据库,文献中曾报道了一例垂体腺瘤继发的高泌乳素血症(405.5ng/ml)患者出现了特发性肉芽肿性乳腺炎,尚未见高泌乳素血症引起乳腺癌的病例报道。但已有研究表明,泌乳素受体(PRLR)在乳腺癌中高表达,且PRLR是影响三阴性乳腺癌患者预后的一个独立危险因素。泌乳素及其受体可能通过MAPK信号通路参与子宫内膜癌的发生发展过程。另有文献报道了一例子宫肌瘤(直径8cm)的患者出现了高泌乳素血症(150ng/ml),但当肌瘤切除后,其泌乳素水平恢复正常(3.43ng/ml)。因此,高泌乳素血症与肿瘤的关系尚不完全明确。高泌乳素血症是肿瘤发生的始动因素,还是伴随症状,目前仍存在争议。
该患者肿块切除术前血清泌乳素曾高达4000ng/ml,出现溢乳闭经症状,肿块切除后虽服用药物溴隐亭,其泌乳素仍未降至正常水平,于术后一年复发,行改良根治术。复查病理,第一次肿块切除呈现了高分泌性增生、假泌乳性增生、导管上皮不典型增生及导管内癌的级谱样改变;第二次根治的标本大部分区域和第一次相似,但局部区域呈现明显浸润,表明该病变经历了分泌性增生-不典型增生-原位癌-浸润癌的连续动态变化过程。笔者认为这可能与患者长期处于泌乳素高分泌状态的刺激有关,提示高泌乳素血症或将成为乳腺癌发生的高危因素。目前,该患者经过术后常规8个周期的化疗后,其泌乳素仍稍高于正常水平(38.24ng/ml),暂未行其他治疗,一般情况良好。
首次肿块切除多家病理诊断意见不一,之所以未诊断导管内癌,提示该肿瘤极为罕见,对该类型乳腺癌尚缺乏认知。会诊意见虽未诊断导管内癌,但均提示并非纯良性病变,而是存在恶变的风险。病理诊断需与特殊类型的乳腺癌如分泌型癌、富于脂质癌、富于糖原透明细胞癌以及高泌乳性乳腺增生等相鉴别,高泌乳素血症病史对疾病的诊断具有重要的提示意义。
(济南市第四人民医院 王 静)
(山东大学齐鲁医院 邢爱艳)
Copyright © 2022 中国医学著作网 医步(北京)医学研究院 all rights reserved 备案号:京ICP备20023519号-2